ວັນທີ 5 ກໍລະກົດ, Novo Nordisk ໄດ້ເປີດຕົວການທົດລອງທາງຄລີນິກໄລຍະ III ຂອງການສັກຢາ CagriSema ໃນປະເທດຈີນ, ຈຸດປະສົງແມ່ນເພື່ອສົມທຽບຄວາມປອດໄພແລະປະສິດທິພາບຂອງການສັກຢາ CagriSema ກັບ semeglutide ໃນຄົນເຈັບທີ່ເປັນໂລກອ້ວນແລະນ້ໍາຫນັກເກີນໃນປະເທດຈີນ.
ການສັກຢາ CagriSema ແມ່ນການປິ່ນປົວດ້ວຍການປະສົມປະສານທີ່ມີປະສິດຕິຜົນຍາວນານພາຍໃຕ້ການພັດທະນາໂດຍ Novo Nordisk, ອົງປະກອບຕົ້ນຕໍແມ່ນ GLP-1 (glucagon-like peptide-1) receptor agonist smeglutide ແລະ amylin analog cagrilintide ທີ່ມີປະສິດຕິພາບຍາວ.ການສັກຢາ CagriSema ສາມາດຖືກປະຕິບັດພາຍໃຕ້ຜິວຫນັງຫນຶ່ງຄັ້ງຕໍ່ອາທິດ.
ຈຸດປະສົງຕົ້ນຕໍແມ່ນເພື່ອປຽບທຽບ CagriSema (2.4 mg / 2.4 mg) ກັບ semeglutide ຫຼື placebo ອາທິດລະຄັ້ງ subcutaneously.Novo Nordisk ໄດ້ປະກາດຜົນຂອງການທົດລອງ CagriSema ສໍາລັບການປິ່ນປົວພະຍາດເບົາຫວານຂັ້ນຕອນທີ 2, ເຊິ່ງໄດ້ພິສູດວ່າຜົນກະທົບຂອງ hypoglycemic ຂອງ CagriSema ແມ່ນດີກວ່າຂອງ semeglutide, ແລະເກືອບ 90% ຂອງວິຊາໄດ້ບັນລຸເປົ້າຫມາຍ HbA1c.
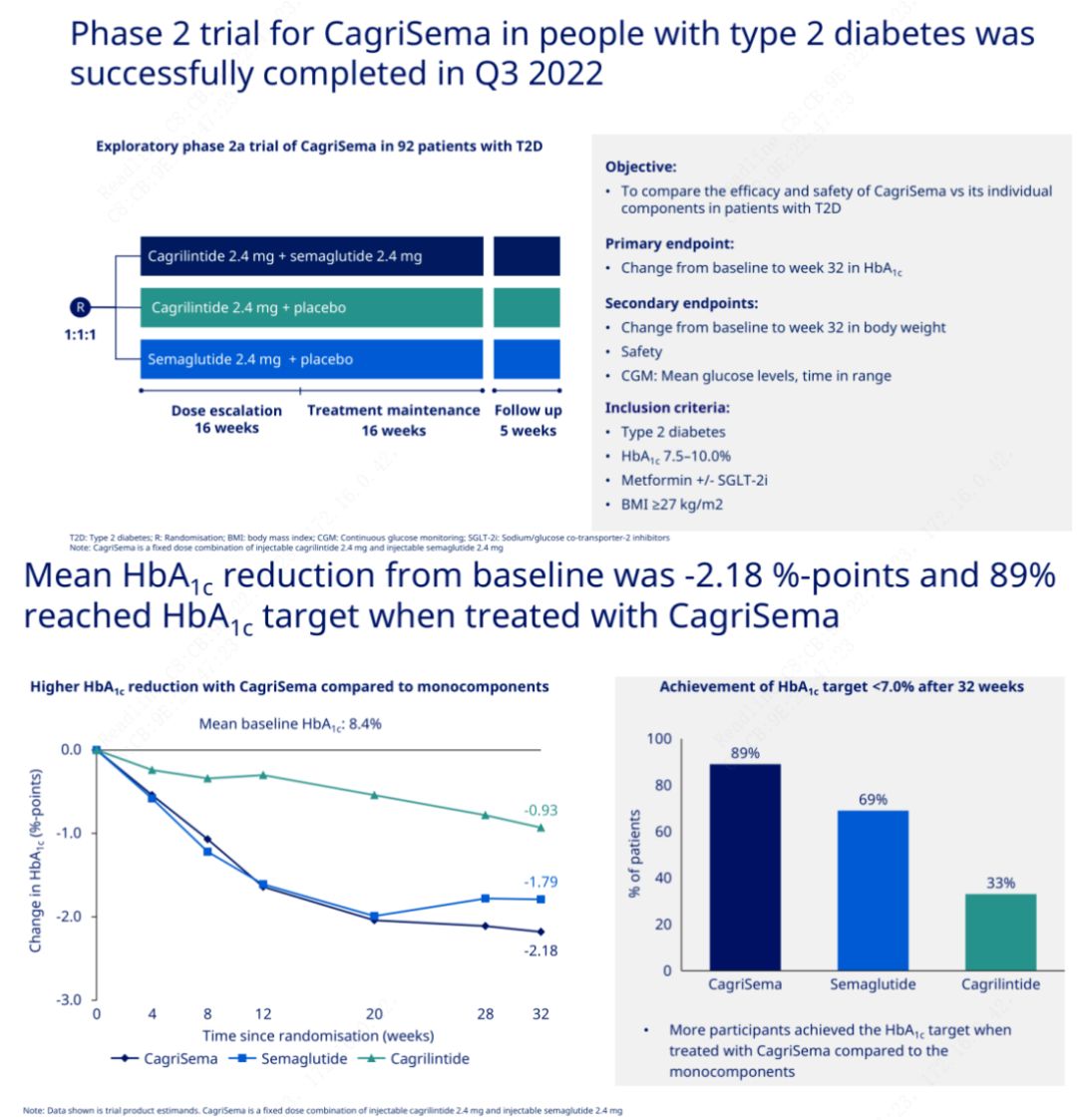
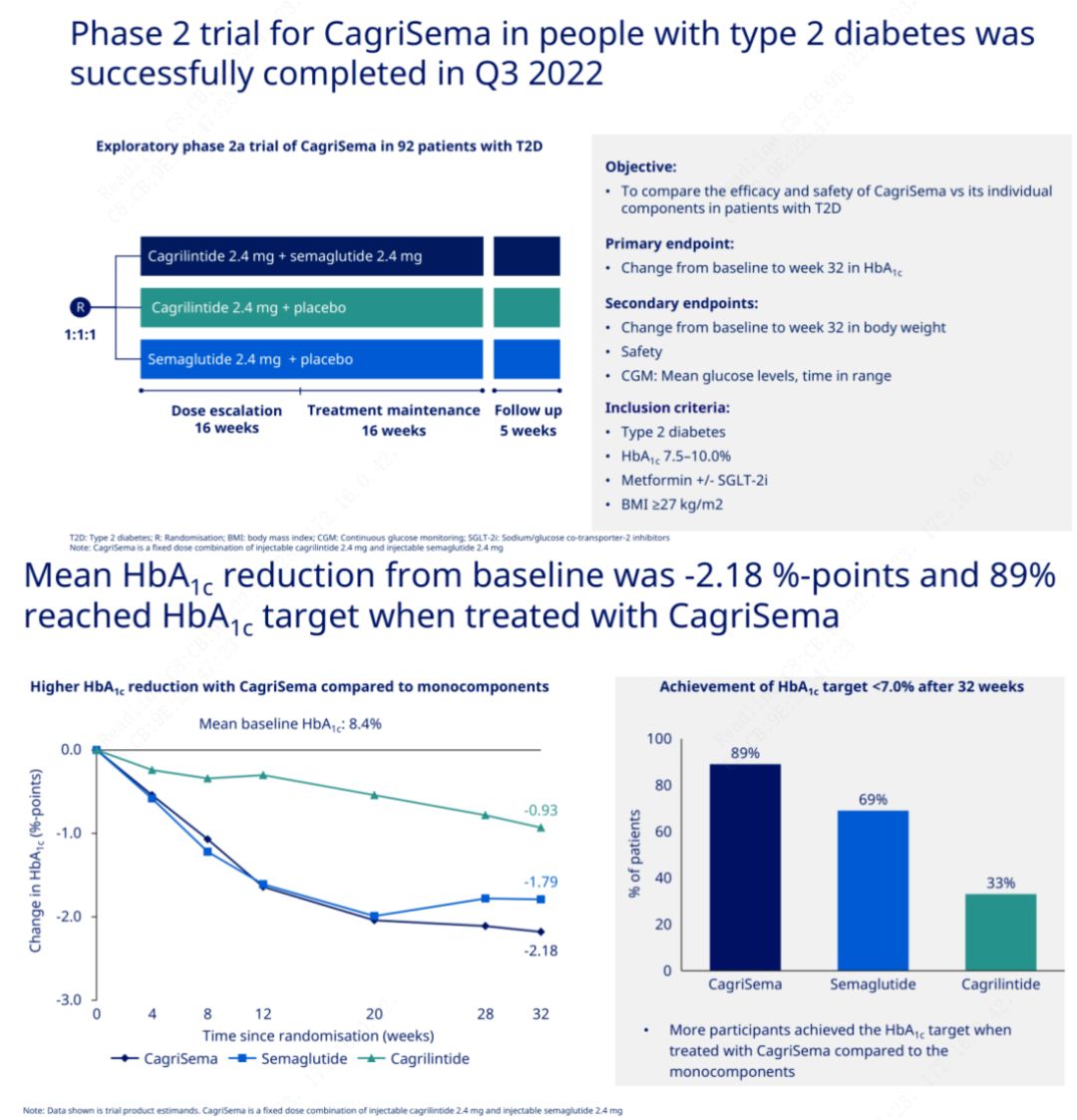
ຂໍ້ມູນໄດ້ສະແດງໃຫ້ເຫັນວ່ານອກເຫນືອໄປຈາກຜົນກະທົບ hypoglycemic ທີ່ສໍາຄັນ, ໃນແງ່ຂອງການສູນເສຍນ້ໍາ, ການສັກຢາ CagriSema ຢ່າງຫຼວງຫຼາຍ outperformed semeglutide (5.1%) ແລະ cagrilintide (8.1%) ກັບການສູນເສຍນ້ໍາຂອງ 15.6%.
ຢາ Tirzepatide ທີ່ມີນະວັດຕະກໍາເປັນຢາ GIP / GLP-1 receptor agonist ປະຈໍາອາທິດທີ່ໄດ້ຮັບການອະນຸມັດຄັ້ງທໍາອິດຂອງໂລກ.ມັນປະສົມປະສານຜົນກະທົບຂອງສອງ incretins ເຂົ້າໄປໃນໂມເລກຸນດຽວທີ່ສັກຢາຫນຶ່ງຄັ້ງຕໍ່ອາທິດແລະເປັນປະເພດໃຫມ່ຂອງການປິ່ນປົວພະຍາດເບົາຫວານປະເພດ 2.Tirzepatide ໄດ້ຖືກອະນຸມັດໂດຍອົງການອາຫານແລະຢາສະຫະລັດ (FDA) ໃນເດືອນພຶດສະພາ 2022 ເພື່ອປັບປຸງການຄວບຄຸມ glycemic (ບົນພື້ນຖານອາຫານແລະການອອກກໍາລັງກາຍ) ໃນຜູ້ໃຫຍ່ທີ່ມີໂລກເບົາຫວານປະເພດ 2 ແລະປະຈຸບັນໄດ້ຮັບການອະນຸມັດຢູ່ໃນສະຫະພາບເອີຣົບ, ຍີ່ປຸ່ນແລະປະເທດອື່ນໆ.
ໃນວັນທີ 5 ເດືອນກໍລະກົດ, Eli Lilly ໄດ້ປະກາດການສຶກສາໄລຍະ III SURPASS-CN-MONO ກ່ຽວກັບການລົງທະບຽນການທົດລອງທາງດ້ານການຊ່ວຍຢາແລະເວທີການເປີດເຜີຍຂໍ້ມູນສໍາລັບການປິ່ນປົວຄົນເຈັບພະຍາດເບົາຫວານປະເພດ 2.SURPASS-CN-MONO ແມ່ນການສຶກສາແບບສຸ່ມ, ຕາບອດສອງເທົ່າ, ຄວບຄຸມ placebo ໄລຍະ III ທີ່ຖືກອອກແບບມາເພື່ອປະເມີນປະສິດທິພາບແລະຄວາມປອດໄພຂອງການປິ່ນປົວດ້ວຍ monotherapy tirzepatide ເມື່ອທຽບກັບ placebo ໃນຄົນທີ່ມີພະຍາດເບົາຫວານປະເພດ 2.ການສຶກສາໄດ້ວາງແຜນທີ່ຈະລວມເອົາຄົນເຈັບ 200 ຄົນທີ່ມີພະຍາດເບົາຫວານປະເພດ 2 ທີ່ບໍ່ໄດ້ຢູ່ໃນຢາຕ້ານພະຍາດເບົາຫວານໃດໆໃນ 90 ມື້ກ່ອນການຢ້ຽມຢາມ 1 (ຍົກເວັ້ນໃນບາງສະຖານະການທາງດ້ານການຊ່ວຍ, ເຊັ່ນ: ພະຍາດສ້ວຍແຫຼມ, ການເຂົ້າໂຮງຫມໍ, ຫຼືການຜ່າຕັດທາງເລືອກ, ໄລຍະສັ້ນ (≤14). ມື້) ການນໍາໃຊ້ insulin).
ພະຍາດເບົາຫວານປະເພດ 2 ຄາດວ່າຈະໄດ້ຮັບການອະນຸມັດໃນປີນີ້
ໃນເດືອນແລ້ວນີ້, ຜົນໄດ້ຮັບຂອງການສຶກສາ SURPASS-AP-Combo ໄດ້ຖືກຈັດພີມມາໃນວັນທີ 25 ເດືອນພຶດສະພາໃນວາລະສານ blockbuster Nature Medicine.ຜົນໄດ້ຮັບສະແດງໃຫ້ເຫັນວ່າເມື່ອປຽບທຽບກັບ insulin glargine, Tirzepatide ສະແດງໃຫ້ເຫັນດີກວ່າ HbA1c ແລະການຫຼຸດຜ່ອນນ້ໍາຫນັກຂອງປະຊາກອນຂອງຄົນເຈັບພະຍາດເບົາຫວານປະເພດ 2 ໃນພາກພື້ນອາຊີປາຊີຟິກ (ສ່ວນໃຫຍ່ແມ່ນປະເທດຈີນ): ການຫຼຸດຜ່ອນ HbA1c ສູງເຖິງ 2.49% ແລະນ້ໍາຫນັກຫຼຸດລົງເຖິງ 7.2 ກິໂລ. (9.4%) ໃນ 40 ອາທິດຂອງການປິ່ນປົວ, ການປັບປຸງຢ່າງຫຼວງຫຼາຍຂອງໄຂມັນໃນເລືອດແລະຄວາມດັນເລືອດ, ແລະຄວາມປອດໄພແລະຄວາມທົນທານໂດຍລວມແມ່ນດີ.
ການທົດລອງທາງດ້ານຄລີນິກໄລຍະ 3 ຂອງ SURPASS-AP-Combo ແມ່ນການສຶກສາຄັ້ງທໍາອິດຂອງ Tirzepatide ທີ່ດໍາເນີນຢູ່ໃນຄົນເຈັບຈີນທີ່ເປັນໂລກເບົາຫວານປະເພດ 2, ນໍາໂດຍສາດສະດາຈານ Ji Linong ຈາກໂຮງຫມໍປະຊາຊົນຂອງມະຫາວິທະຍາໄລ Peking.SURPASS-AP-Combo ແມ່ນສອດຄ່ອງກັບຜົນຂອງການຄົ້ນຄວ້າຊຸດ SURPASS ທົ່ວໂລກ, ເຊິ່ງໄດ້ພິສູດຕື່ມອີກວ່າ pathophysiology ຂອງພະຍາດເບົາຫວານໃນຄົນເຈັບຈີນແມ່ນສອດຄ່ອງກັບຄົນເຈັບທົ່ວໂລກ, ເຊິ່ງເປັນພື້ນຖານສໍາລັບການຄົ້ນຄວ້າແລະການພັດທະນາພ້ອມກັນຂອງຢາໃຫມ່. ໃນຈີນແລະໂລກ, ແລະຍັງໃຫ້ການສະໜັບສະໜູນຫຼັກຖານອັນໜັກແໜ້ນເພື່ອໃຫ້ຄົນຈີນມີໂອກາດໃຊ້ຢາປິ່ນປົວພະຍາດເບົາຫວານທີ່ຫຼ້າສຸດແລະການນຳໃຊ້ທາງຄລີນິກໃນຈີນໃຫ້ໄວເທົ່າທີ່ຈະໄວໄດ້.
ເວລາປະກາດ: ກັນຍາ-18-2023

